医院里的“神秘白盒药”:关于临床试验药物那些事儿
“大夫,这个药盒咋这么素啊?连个商标都没有。”
“您说的这个试验药靠不靠谱啊?”
“这个新药和我在药房买的有啥区别?”
“新药上市”常被视为医学进步的里程碑,但鲜为人知的是,一种药物从实验室走向药房柜台,往往要经历漫长而严格的临床试验阶段。
在这个过程中,有些药物被称为“试验药”,它们与已经上市的常规药品有何不同?
身份地位:合法“上岗证”的差异
想象一下,临床试验药物就像正在参加入职考核的新员工,它们尚处于“试用期”,还没有获得国家药监局的正式“工作证”,即未被批准上市。这些药物可能最终“转正”,成为常规药品,也可能因表现不佳而被“辞退”,即试验失败。
相比之下,常规药品则是已经通过严格考核的正式员工,它们持证上岗,工作内容和范围都有明确规定,包括适应症、用法用量等。
安全档案:了解程度的深浅
河南省肿瘤医院药学部副主任、主任药师贺宝霞介绍,对于临床试验药物,只有初步的“背景调查”数据,这些数据主要来自动物实验和早期人体试验。就像新员工一样,它们的“性格特点”尚未完全摸清,可能存在潜在风险,如无效或存在未知副作用。
而常规药品则经过了全面的“背景审查”,包括大量临床试验和实际使用数据。它们的“性格特点”已经被充分掌握,常见的不良反应都已记录在案,医生在使用时能够更有把握。
使用规则:谁可以用?怎么用?
临床试验药物的使用规则非常严格,仅限符合入组标准的参与者使用,就像“特邀嘉宾”一样。使用方式也必须严格遵循试验方案,不能随意更改。
常规药品则面向所有符合条件的患者,就像“普通观众”一样。医生可以根据患者的具体情况,个体化地调整用药方案,使用方式更加灵活。
监管力度:管理严格程度不同
临床试验药物在研发过程中受到全程“重点监护”,从生产、包装、标签、运输、储存、发放、使用到回收、退回和销毁等各个环节,都有严格的规定和要求。它们需要遵循《药物临床试验质量管理规范》(GCP)等相关法规和标准,验证试验用药品的安全性和有效性。同时,还需要药监局批准、伦理委员会批准以及参与者的知情同意,多重担保确保万无一失。
常规药品的监管则相对宽松一些,它们会接受定期的质量抽查和不良反应监测,就像常规“健康体检”一样。监管部门主要关注它们的“工作表现”,即安全性跟踪。
获取途径:如何得到它们?
想要获取临床试验药物,就像参加限时限量的特供活动一样。这些药物仅在试验期间免费提供,部分试验药还可通过“同情用药”(对生命垂危、无药可用的患者使用临床试验药物)途径获得。但要想成为参与者,还需要经过严格的报名筛选审核流程,符合条件才能入组。
常规药品则可以通过常规销售渠道轻松获得,如医院、药店等。患者可以根据需要凭处方购买处方药,或者自行购买非处方药。
外观设计:如何区分它们?
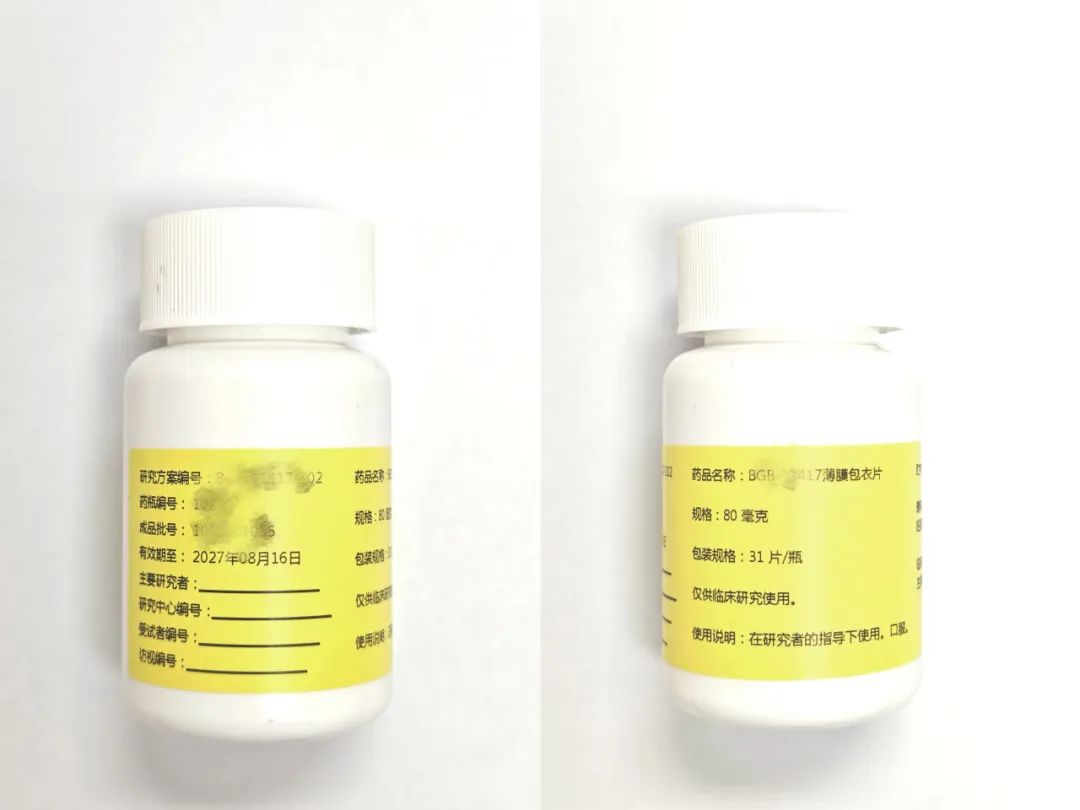
从包装上,也能一眼区分出临床试验药物和常规药品。临床试验药物的包装通常简化,以白色或单色为主,避免商业化的图案或色彩。为了区分不同的试验组别,它们可能会通过颜色代码或编号来标识不同剂量组,如红色标签代表高剂量,蓝色标签代表低剂量。此外,包装上还会印有“仅限临床试验用”、申办方信息和方案名称等特殊标识。
常规药品的包装则更加品牌化,常有企业标志、防伪标识和品牌专属配色。为了方便患者使用,包装上还会提供患者友好信息,如掰痕(方便分剂量)、盲文标识(部分国家要求)和儿童安全瓶盖等。
总结与提醒
贺宝霞提醒,临床试验药物虽然免费,但需要承担未知风险;常规药品虽已获批上市,但仍需遵医嘱使用。
两者各有价值:前者是推动医学进步的重要力量,后者则是保障当前治疗的有效手段。无论是考虑参与临床试验,还是日常用药,这些基本知识都能帮助做出更适宜的选择。
来源:河南省肿瘤医院
编辑:刘斐斐 审核:荣强
- 上一篇
久坐族,腰痛如刀割?腰痛≠腰椎间盘突出
急性腰痛(病程≤4周)≠腰椎间盘突出,还可能是第三腰椎横突综合征。
- 下一篇
开空调紧闭门窗制冷效果才好?医生提醒:当心室内空气攒“毒”
三伏天里,躲进空调房享受清凉是不少人的避暑首选。然而,这阵阵凉风背后,可能暗藏健康危机。 “我们科室就收治过几例化疗后的患者,他们在打扫久未居住的老房子时,因为没做好防护,吸入霉菌后患上了真菌性肺炎。”河南省肿瘤医院呼吸内科主任医师何振说,长期不清洁的空调滤网,恰恰会制造出类似的致病环境,一旦空调开启,这些霉菌就会随着冷风在密闭空间里四处飘散。对于免疫力较弱的儿童、老人,尤其是正在接受化疗的患者来说,吸入后可能引发真菌性肺炎——临床上,这类病例并不少见。
相关文章
- 蝴蝶的警报 别让颈部的“小蝴蝶”扰乱你的生活
- 交流互鉴启新程,共话肩肘微创技术新发展
- 数智赋能,云端共享!河南省洛阳正骨医院(河南省骨科医院)手术直播演示可视化智能辅助系统下全髋关节置换
- 读懂孩子的“心灵感冒”:关注儿童青少年抑郁
- 乳腺结节到底是什么?一文读懂它的真相
- 要命的不是肿瘤等疾病,而是无休止的“内耗” 专家:用“五会”法则,走向快乐生活
- 国庆中秋我在岗!致敬平凡岗位上不平凡的坚守…...
- 精准护航:河南省洛阳正骨医院(河南省骨科医院)郑州院区小儿骨伤与矫形科成功开展导航辅助下治疗儿童股骨头骨骺滑脱手术
- NT到底查什么?你知道吗
- 2400多公里转运救治危重烧伤患者,郑州市第一人民医院医疗团队上演 “爱的接力”


